

乐鱼体育网页

乐鱼体育官网入口:
溶液,持续滴加;试验完毕后,将设备B中溶液蒸腾浓缩、冷却结晶、抽滤、乙醇洗刷、枯燥,得到产品。用无水乙醇洗刷的意图是
①滴定管的正确操作次序:检漏→_______(填字母)→记载开端读数→开端滴定。
-

,遇水发生剧烈反响,生成一种氢化物和两种氧化物。某小组规划试验制备亚硝酰氯并测定其纯度,制备原理:
对试验发生搅扰。然后经过操控止水夹开关,使两种气体在D中反响,当三颈瓶内有少数液体时中止反响。

(1)Ni2O3有强氧化性,加压酸浸时,有气体发生且镍被复原为Ni2+,则发生的气体为___(填化学式)。
(2)滤渣D为单质镍、硫的混合物,请写出向浸出液B中通入H2S气体生成单质镍的离子方程式:____。

已知:①孔雀石主要成分是CuCO3·Cu(OH)2,不溶于水;含少数杂质FeO、Fe2O3、SiO2。

(1)如图过滤设备中有两处显着过错,一处是未用玻璃棒引流,另一处是__。

(4)用电解法也能够制备KClO4,在无隔阂、微酸性条件下,电解食盐水得到NaClO3溶液,再经过一系列转化和操作得到产品。
II.该进程制得的KClO4样品中含少数KCl杂质,为测定产品纯度进行如下试验:精确称取5.7635 g样品溶于水中,配成250 mL溶液,从中取出25.00 mL于锥形瓶中,参加适量葡萄糖,加热使ClO4-悉数转化为Cl-,反响为:
③NaBH4与水反响生成NaBO2和H2,该反响生成的氧化产品与复原产品的物质的量之比为____________________。

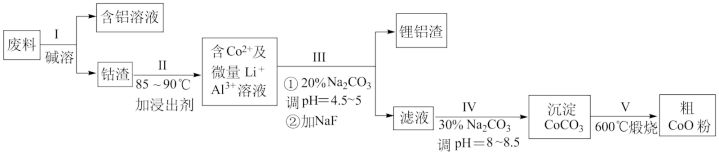
(2)进程I中选用NaOH溶液溶出废猜中的Al,反响的离子方程式为_______。
(3)进程II中先参加稀H2SO4酸化,再参加Na2S2O3溶液,则浸出钴的化学反响方程式为(产品中只要一种酸根)_______。在试验室模仿工业生产时,也可用盐酸浸出钴,但实践工业生产里不必盐酸,则不必盐酸的底子原因是_______。
(4)碳酸钠溶液在进程III和IV中所起作用不一样,请写出在进程IV中起的作用是_______。


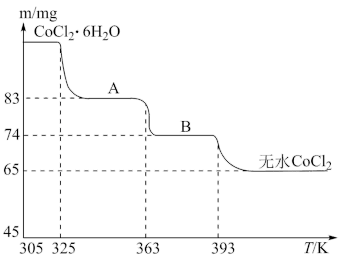
(6)CoO溶于盐酸得粉赤色CoCl2溶液。CoCl2含结晶水数目不同而出现不一样的色彩,使用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。如图是粉赤色CoCl2·6H2O晶体受热时,剩下固体质量随气温改变的曲线,A物质的化学式是_______。
-
,为了避免烧瓶中盐酸浓度下降,试验进程中需求经过火液漏斗不断向设备A中滴加浓盐酸,盐酸坚持较高浓度的原由于
-某校化学小组学生使用下图所示设备进行“乙二酸晶体受热分化”的试验,并验证分化产品中有CO

(3)试验完毕后,设备F中黑色氧化铜变为赤色固体。简述查验赤色固体中是否含有Cu2O的试验办法(已知Cu2O溶于稀硫酸生成铜单质和硫酸铜):______。
(4)①草酸和草酸钠(Na2C2O4)能够在酸性条件下被KMnO4、MnO2氧化。KMnO4和草酸钠在稀硫酸中反响的离子方程式是______。